jun 27, 2019
Philips verkrijgt PMA-goedkeuring voor verkoop HeartStart-defibrillatoren in de VS
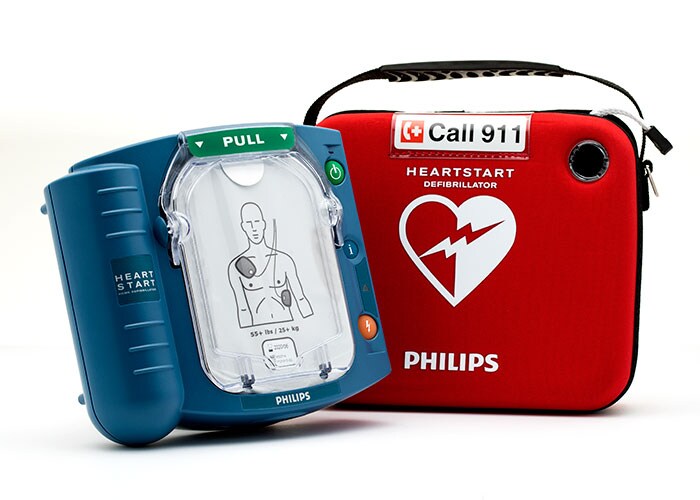
Twee defibrillatoren van Philips – de M5066A HeartStart OnSite en de M5068A HeartStart Home – hebben van de Amerikaanse medisch toezichthouder FDA de zogenaamde pre-market approval (PMA) verkregen. Dat betekent dat beide apparaten en hun accessoires (zoals batterijen en elektroden) zijn goedgekeurd voor verkoop op de Amerikaanse markt. De goedkeuring werd verleend door het Center for Devices and Radiological Health (CDRH). Dit is de afdeling van de Food & Drug Administration (FDA) die onder meer is belast met het controleren van de kwaliteit van medische apparatuur. Defibrillatoren zijn sinds kort onderhevig aan de strengst mogelijke controle. Toestellen waarvoor een pre-market approval (PMA) nodig is, vallen onder de zwaarste medische klasse.
Wij zetten ons in voor hoogwaardige en innovatieve AED’s die op de persoon afgestemde hulp kunnen bieden aan slachtoffers van een plotselinge hartstilstand.
Bente de Lat
Philips Sr. Project Manager Cardiology
"Wij zetten ons in voor hoogwaardige en innovatieve AED’s die op de persoon afgestemde hulp kunnen bieden aan slachtoffers van een plotselinge hartstilstand", aldus Bente de Lat. Sr. Project Manager Cardiology van Connected Care, Biosensing & Indirect Channels bij Philips Benelux. “De PMA-goedkeuring van de FDA laat zien wat een geweldig werk onze teams hebben geleverd. Voor een geslaagde PMA-aanvraag is zeer uitgebreide technische en klinische documentatie nodig. Ook moet er een breed scala aan productiegegevens worden overlegd.”
Uniek voor de VS: verkrijgbaar zonder verwijsbrief
De HeartStart OnSite en HeartStart Home zijn uniek voor de VS: het zijn de enige automatische externe defibrillatoren (AED's) die straks over-the-counter beschikbaar zijn voor Amerikaanse consumenten. Voor AED’s was in de VS voorheen altijd een verwijsbrief nodig. Defibrillatoren redden jaarlijks vele mensenlevens. In Nederland vinden er jaarlijks 8000 reanimaties per jaar buiten het ziekenhuis plaats. In 70% van de gevallen gebeurt dat thuis, de overige reanimaties vinden plaats op straat, in een openbaar gebouw of tijdens sport of ontspanning, nog voordat de ambulance ter plaatse is. In drie van de vier gevallen zijn dan omstanders verantwoordelijk voor de reanimatie.
Voorbereid op Europese MDR-regelgeving
Beide Philips-defibrillatoren kenden al een 510(k)-goedkeuring van de FDA. Daar komt nu de PMA-goedkeuring bovenop. Met deze goedkeuring is Philips uitstekend voorbereid op de nieuwe Europese Medical Devices Regulations (MDR) die in 2020 van kracht worden.
Over Philips
Koninklijke Philips N.V. (NYSE: PHG; AEX: PHIA) is toonaangevend op het vlak van gezondheidstechnologie en richt zich op het verbeteren van de gezondheid van mensen en het bereiken van betere zorgresultaten binnen het gezondheidscontinuüm, van gezond leven en preventie tot diagnostiek, behandeling en thuiszorg. Philips maakt gebruikt van geavanceerde technologieën en diepgaand inzicht in klinische toepassingen en de behoeften van consumenten om geïntegreerde oplossingen te ontwikkelen. De onderneming is marktleider op het gebied van diagnostische beeldvorming, beeldgestuurde behandelingen, medische IT toepassingen, patiëntbewaking, thuiszorgsystemen en gezondheidstoepassingen voor consumenten. Het hoofdkantoor van Philips is gevestigd in Nederland. Met wereldwijd circa 77.000 medewerkers en verkoop- en servicepunten verspreid over meer dan 100 landen genereerden de activiteiten op het gebied van gezondheidstechnologie in 2018 een omzet van 18,1 miljard euro. Voor nieuws over Philips kan u terecht op www.philips.be.