juin 27, 2019
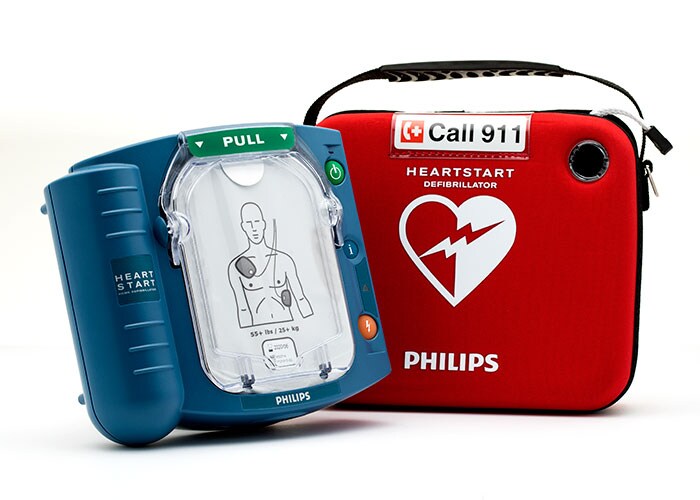
Philips obtient l’autorisation PMA pour la vente des défibrillateurs HeartStart aux États-Unis
La FDA, l’autorité américaine de surveillance pour les appareils médicaux, a émis une approbation pré-marché (PMA) pour deux défibrillateurs de Philips – le M5066A HeartStart OnSite et le M5068A HeartStart Home. Les deux appareils et leurs accessoires (comme les batteries et les électrodes) sont donc approuvés pour la vente sur le marché américain. Cette approbation est émise par le Center for Devices and Radiological Health (CDRH), un service de la Food & Drug Administration (FDA) spécialisé notamment sur le contrôle de la qualité des appareils médiaux. Depuis peu, les défibrillateurs sont soumis aux contrôles les plus stricts possibles. Les appareils nécessitant une approbation pré-marché (PMA) font partie de la classe des dispositifs médicaux avec les critères les plus stricts.
Nous souhaitons développer des défibrillateurs de qualité et innovateurs qui sont adaptés aux besoins des personnes et qui sont en mesure d’aider les victimes d’un arrêt cardiaque soudain.
Bente de Lat
Sr. Project Manager Cardiology de Connected Care, Biosensing & Indirect Channels chez Philips Benelux.
« Nous souhaitons développer des défibrillateurs de qualité et innovateurs qui sont adaptés aux besoins des personnes et qui sont en mesure d’aider les victimes d’un arrêt cardiaque soudain », explique Bente de Lat. Sr. Project Manager Cardiology de Connected Care, Biosensing & Indirect Channels chez Philips Benelux. « L’approbation PMA de la FDA montre que nos équipes ont fourni un excellent travail. Pour une demande d’approbation pré-marché, il est nécessaire de fournir des documents cliniques et techniques extrêmement détaillés. En outre, de très nombreuses données relatives aux produits doivent être présentées ».
Unique pour les États-Unis : disponible sans prescription
Les HeartStart OnSite et HeartStart Home présentent un aspect unique pour les États-Unis. Ces défibrillateurs automatisés externes seront alors les seuls disponibles en vente libre pour les consommateurs américains. Le HeartStart Home est en outre le seul défibrillateur qui convient spécifiquement à un usage domestique. Auparavant, une prescription médicale était toujours nécessaire pour l’acquisition d’un défibrillateur.
Prêt pour la législation européenne DDM
Les deux défibrillateurs Philips bénéficiaient déjà d’une approbation 510(k) de la FDA. Désormais, ils ont obtenu l’approbation PMA. Avec cette approbation, Philips est prêt pour la nouvelle Directive européenne sur les dispositifs médicaux (DDM) qui entrera en vigueur en 2020.
À propos de Philips
Royal Philips (NYSE : PHG, AEX : PHIA) est l'une des plus importantes entreprises technologiques de santé. Focalisée sur l'amélioration de la santé et l'optimisation des perspectives dans le parcours des soins de santé, d'une vie saine au diagnostic et au traitement, en passant par la prévention, sans oublier les soins à domicile. Philips tire parti de technologies de pointe et d'une connaissance approfondie des consommateurs et du monde clinique pour proposer des solutions intégrées. L'entreprise est l'un des leaders de l'imagerie diagnostique, des thérapies assistées par l'imagerie, de la surveillance des patients et de l'informatique de santé, ainsi que de la santé grand public et des soins à domicile. Philips, dont le siège social se trouve aux Pays-Bas, a réalisé avec son portefeuille de technologies de santé un chiffre d'affaires de 17,4 milliards d'euros en 2016 et emploie quelque 71.000 personnes actives dans les domaines de la vente et des services dans plus de 100 pays. Pour plus d'informations sur Philips, consultez le site www.philips.be.